GYÓGYSZERÉSZSZAKMAI
INFORMÁCIÓK
Az elmúlt időszak számos többletfeladatot hozott a mindennapokban a közforgalomban dolgozó gyógyszerészek számára. A gyógyszerész szakmát érintő jogszabályi környezet folyamatos változása a napi szintű kihívások mellett komoly terhelést jelent a gyógyszertár-vezetőknek, gyógyszerészeknek. Fontos érték lett a naprakész tájékozódás, a releváns információk megismerése.
Ezért hívtuk életre gyógyszerészszakmai támogató felületünket, melynek segítségével rendszeres tájékoztatással és hasznos tartalmakkal segítjük partnereinket a szakmát érintő fontos jogszabályi és egyéb változásokkal kapcsolatban.
Ellenőrzött szerek kezelése
Ellenőrzött szerek kezelése
A napi expediálásban előforduló ellenőrzött szerek kezelésével kapcsolatban dr. Gyarmati Kinga gyógyszerészszakmai vezető készített fontos összefoglalót.
 Beszéljünk egy kicsit az ellenőrzött szerekkel történő patikai eljárásrendről. Ebben a cikkben a nagy általánosságban a napi szintű gyakorlatban előforduló esetek alapján a felírást, a kiadást és a rendelést járom körbe.
Beszéljünk egy kicsit az ellenőrzött szerekkel történő patikai eljárásrendről. Ebben a cikkben a nagy általánosságban a napi szintű gyakorlatban előforduló esetek alapján a felírást, a kiadást és a rendelést járom körbe.
Az elsődleges jogszabályi hátteret a 43/2005. (X. 15.) EüM rendelet – a fokozottan ellenőrzött szernek minősülő gyógyszerek orvosi rendelésének, gyógyszertári forgalmazásának, egészségügyi szolgáltatóknál történő felhasználásának, nyilvántartásának és tárolásának rendjéről – adja.
Mit nevezünk fokozottan ellenőrzött szernek? Melyek azok az alapanyagok, illetve készítmények, amelyek ezen rendelet alá tartoznak?
– A kábítószer és pszichotróp anyag: az ellenőrzött anyagokról szóló 78/2022. (XII. 28.) BM rendelet (a továbbiakban: BM rendelet) 1. melléklet K1 és K2 jegyzékén, a BM rendelet 2. melléklet P2, P3 és P4 jegyzékén szereplő anyagok gyógyszeralapanyagként, valamint az ezeket az anyagokat tartalmazó gyógyszerek, kivéve a BM rendelet 1. melléklet K3 jegyzékén szereplő anyagokkal megegyező összetételű gyógyszereket;
– A fokozottan ellenőrzött szer: a BM rendelet 1. melléklet K1 és K2 jegyzékén, a BM rendelet 2. melléklet P2 jegyzékén szereplő anyagok gyógyszeralapanyagként, valamint az ezeket az anyagokat tartalmazó gyógyszerek.
Részletesebben: https://net.jogtar.hu/jogszabaly?docid=a2200078.bm
Felírásra vonatkozó szabály
Ezek a készítmények mind elektronikusan (22-es eRecept), mind papír alapon (21-es) felírhatóak. Ezt azért emelem ki, mert a két típusú felírás között eltérőek a kötelező alaki kellékek.
- A 22-s eRecept esetén kötelezően látszódnia kell a TÉR-ben:
- a készítmény hatáserősségének arab számmal feltüntetve (pld.: DUROGESIC 25 µg/óra transzdermális tapasz)
- adagolási egységben (pld.: tabletta, ampulla, tapasz stb.) kifejezett adagjának római számmal, latin nyelven kiírva. Minden esetben bontásban, darabszámra kötelező felírni! (pld.: V.quinque)
- adagolására vonatkozó utasításnak, melyet egyértelműen kell megadni (pld.: 3 naponta 1 tapasz)
Amennyiben az expediáló kollégák hibát tapasztalnak a TÉR-ben felírt eRecept esetén, minél hamarabb fel kell venni a felíró orvossal a kapcsolatot a javítás miatt. Hibásan felírt eReceptet tilos expediálni!
- A 21-es, papír alapú recept esetén a következő alaki kellékek kötelezőek:
- a készítmény hatáserőssége arab számmal és latin nyelven feltüntetve (pld.: DUROGESIC 25 µg, viginti quinque µg /óra transzdermális tapasz)
- adagolási egységben (pld.: tabletta, ampulla, tapasz stb.) kifejezett adag római számmal, latin nyelven kiírva. Minden esetben bontásban, darabszámra kötelező felírni! (pld.: V.quinque)
- adagolására vonatkozó utasítás, melyet egyértelműen kell megadni (pld.: 3 naponta 1 tapasz)
Mindkét típusú felírás esetén, amennyiben az orvos magisztrális készítményt rendel, kötelező
- a gyógyszerben foglalt fokozottan ellenőrzött szer mennyiségét arab számmal és latinul, az adagok számát római számmal és betűvel, latin nyelven feltüntetni
- adagolására vonatkozó utasítást egyértelműen megadni
Kiadásra vonatkozó szabály
A vény patikába történő beérkezésekor ellenőrizzük, hogy mikor lett a vény felírva. Ellenőrizzük, hogy a vényre felírt gyógyszert a beteg először kapja-e, vagyis úgynevezett első felírás, vagy Értesítővel érkező, folyamatos, fokozottan ellenőrzött szerrel történő kezelés alatt álló beteg részére történt-e a felírás.
Az első recept felírása szakorvos által történhet. A beteget 15 napra látja el gyógyszerrel. Az adott készítmény ismételt felírása ezek után vagy a háziorvos, vagy a szakorvos kompetenciája, utóbbi abban az esetben, ha az adott gyógyszert kizárólag szakorvos rendelheti.
Mind az eRecept, mind a papír vény esetén a felírás után 5 munkanap a határidő, ami alatt a vény kiváltható. Ezt követően lejárt vényként kell kezelni.
- Értesítő általi kiadás
Az Értesítőt a háziorvos állítja ki. Az Értesítő meghatározza a kiadás gyakoriságát, de azt úgy kell meghatározni, hogy a felírt mennyiségű fokozottan ellenőrzött szer adagja a 30 napot ne haladja meg.
Ha az orvos a fokozottan ellenőrzött szerrel kapcsolatban a terápiában változtatást hajt végre, kötelező új Értesítőt kiállítania.
Az Értesítő alapján csak abban a patikában szabad kiadni a fokozottan ellenőrzött szert, amelyik patikára szól! Amennyiben a gyógyszertár működésében változás történik, például bezár, akkor erről kötelező értesíteni a beteget vagy hozzátartozót, és átadni a legközelebbi gyógyszertár részére az eredeti gyógyszertár által lepecsételt Értesítőt, az átadás tényét pedig szükséges bejelenteni az NNGYK felé.
- Helyettesíthetőség
Kardinális kérdés a helyettesítés. Helyettesíteni ezeket a készítményeket ugyanúgy lehet, mint bármelyik másik gyógyszert. Amennyiben az adott készítmény nem beszerezhető, és az NNGYK helyettesítési listáján szerepel helyettesítő készítmény, nyugodtan felajánlhatjuk.
Egy speciális szabály van azonban: az Értesítő másolatán a helyettesítést feltüntetve, az orvoshoz az Értesítőt vissza kell juttatni.
Rendelésre, visszavételre, visszárura vonatkozó szabály
Az adminisztrációt minden fent leírt esetben az 5 példányos kábítószer és pszichotróp megrendelő tömbben kell elvégezni.

Megrendelés során a megrendelendő gyógyszer nevét, hatáserősségét és a megrendelendő mennyiséget darabszámon(!), és nem dobozszámon kötelező feltüntetni. Nem szükséges latin nyelven.
A Visszavétel és Visszáru során is ugyanez az eljárás, egy különbséggel: ezekben az esetekben, ahogy a Megrendelőkönyv is meghatározza, a megrendelőlapon fel kell tüntetni, hogy milyen okból történik a visszaküldés.
Gyógyszertári nyilvántartás
Minden beszerzett és kiadott fokozottan ellenőrzött gyógyszerről, alapanyagról kötelező nyilvántartó kartont vezetni.

Selejtezés
Általánosságban elmondható, hogy egy gyógyszertárban ezekből a gyógyszerekből, kevés kivétellel, nem tartanak jelentős készleteket. A selejtezés leginkább az alapanyagokat érinti. Ebben az esetben úgynevezett Selejtezési jegyzőkönyvet állít ki a patika, és ezt fűzi hozzá az Megrendelőkönyvhöz, amikor a selejtezett alapanyagot visszaküldte a nagykereskedőhöz. Ezt a visszaküldésig a leselejtezett hatóanyag mellett érdemes tartani.

Remélem, cikkemmel hasznos információkat tudtam adni a kábító- és fájdalomcsillapító gyógyszerek, mindennapi, általában előforduló gyógyszertári kezeléséhez.
Hibás eSzemélyi igazolványok cseréje
Hibás eSzemélyi igazolványok cseréje
Hibás eSzemélyi igazolványok akadályozzák az elektronikus azonosítási folyamatokat. Cikkemben közzéteszem az érintett okmányok listáját. Dr. Gyarmati Kinga írása.
Az ESZFK Nonprofit Kft.-től kapott tájékoztatás, valamint a Belügyminisztérium Nyilvántartások Vezetéséért Felelős Helyettes Államtitkárság Schengeni és Felhasználó-támogatási Főosztálya által kiadott közlemény szerint az eSzemélyi okmányok egy korábban (jellemzően 2017-ben) kiadott sorozatában egy, az elektronikus azonosítási folyamatot akadályozó hibára derült fény.
Az érintett okmányokban a hibát a DSC – okmány aláíró tanúsítvány lejárata okozza. A hiba sajnos nem javítható, az csak az okmány cseréjével orvosolható, ezért amennyiben az Önök okmánya is a hibás sorozatba tartozik, ezen okmányok cseréjét szükséges elvégezni.
A hibás okmányokat az alábbi táblázat tartalmazza. Itt az adott idősávban kiadott okmányhoz tartozó tanúsítvány lejárata is látható.
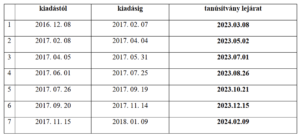
Felhívom szíves figyelmüket, hogy a hibás tanúsítvánnyal rendelkező okmányok személyi azonosításra továbbra is alkalmasak, azonban elektronikus ügyintézésre nem használhatók, így például az Elektronikus Szolgáltatási Térbe (EESZT) sem tudnak belépni vele.
Az eSzemélyi igazolványok lejárata a Mobiltokeneket nem érinti, ezért javaslom, azok a felhasználók, akik már nem tudják az eSzemélyi igazolványukat belépésre használni, az okmány cseréjéig éljenek a Mobiltokenes belépés lehetőségével.
A személyi igazolvány cseréjét bármely kormányablakban kezdeményezhetik. A csere ingyenes.
Felmerülő kérdéseik esetén az ESZFK Ügyfélszolgálat munkatársai az alábbi, egészségügyi szolgáltatók számára biztosított elérhetőségeiken állnak rendelkezésre.
Telefon: +36 1 920 1050
E-mail: helpdesk@eszfk.hu
Dr. Gyarmati Kinga
Gyógyszerészszakmai vezető
Beszéljünk újra az EESZT-felhasználó és a MobilToken regisztrációról!
Beszéljünk újra az EESZT-felhasználó
és a MobilToken regisztrációról!
Sok kérdés érkezik az EESZT különböző felületein történő regisztrációkkal kapcsolatosan. A témák örökzöldek, dr. Gyarmati Kinga Gyógyszerészszakmai vezető összeállítása most végigvisz a két leggyakoribb regisztráció lépésein.
Az elmúlt hetekben több partnerünk is kérte ügyfélszolgálatunk segítségét új munkatárs regisztrációjában az EESZT ágazati portálján, valamint a MobilToken applikáció beállításában. Sok esetben akkor derül ki, hogy az új kolléga vagy még nincs regisztrálva az EESZT ágazati portálján, vagy új eSzemélyi igazolványa van, ami átvételkor a kormányablakban nem került aktiválásra, amikor a vezető az intézményi V-mátrixban szeretné dolgozóját felvenni. Az alábbiakban az új eSzemélyi igazolvánnyal bejelentkező kolléga regisztrációját és a MobilToken regisztráció lépéseit szeretném bemutatni, segítséget nyújtva a feladat elvégzéséhez.
2017. november 1-én indult el Magyarországon az Elektronikus Egészségügyi Szolgáltatás Tér (EESZT). Az indulásakor a felhasználók csak és kizárólag elektronikus személy igazolványt használtak. Az elmúlt, közel 6 évben az EESZT fejlesztői folyamatosan monitorozva a lakosság és az egészségügyi szakemberek igényeit, fejlesztéseket hajtottak létre a felületen. Ennek részeként fejlesztették ki az Állami Egészségügyi Ellátó Központ (ÁEEK) szakemberei az EESZT MobilToken alkalmazást is, melynek segítségével a szakmai felhasználók a személyi igazolvány használata nélkül is be tudnak lépni a Térbe. Az egészségügyi adatok védelme érdekében elengedhetetlen, hogy az EESZT-ben található adatokhoz csak megfelelő biztonsággal azonosított felhasználók férjenek hozzá. Az egészségügyi dolgozók esetében ehhez eddig két dologra volt szükség: az elektronikus személyi igazolványra és a hozzá tartozó hatjegyű PIN kódra. A MobilToken alkalmazás segítségével ezeket a rendszerbe beazonosított mobiltelefonunkkal és a hozzá tartozó hatjegyű PIN kóddal tudjuk kiváltani.
Első körben nézzük meg, hogyan történik az eSzemélyi igazolvány aktiválása.
- Szükség van egy internetkapcsolattal és személyi igazolvány leolvasóval rendelkező munkaállomásra. Ez lehet szerver vagy officinai munkaállomás.
- Szükséges az eSzemélyi igazolvány és a kormányablakban kapott, az aktiváló kódot tartalmazó boríték
- Ezek után lépjünk fel a EESZT ágazati portáljára a https://portal.eeszt.gov.hu/hu/bejelentkezes-eszig

-
- Felhasználónév a végzettségünkből és az alap nyilvántartási számunkból képződik. Ez gyógyszerészek esetén: G és az alap nyilvántartási szám, a gyógyszertári szakasszisztenseknél: S és az alap nyilvántartási szám.
Az alap nyilvántartási szám a Működési Nyilvántartási Igazolvány jobb alsó sarkában található. - Indítsuk el a regisztrációt. A lépések egymás után, folyamatosan mennek végig.


- Felhasználónév a végzettségünkből és az alap nyilvántartási számunkból képződik. Ez gyógyszerészek esetén: G és az alap nyilvántartási szám, a gyógyszertári szakasszisztenseknél: S és az alap nyilvántartási szám.
- Ha végigmentünk a fenti lépéseken, akkor a dolgozó eSzemélyi igazolványa aktiválása megtörtént. Ezt követően a gyógyszertár V-Mátix adminja hozzá tudja rendelni az intézményhez a dolgozóját. Ezt a fenti folyamatot, abban az esetben is kötelező elvégezni, ha a dolgozónak eSzemélyi igazolvány cseréje történt, és a kormányablakban nem történt meg az aktiválás.
Ezt követően, a továbbiakban a MobilToken regisztráció lépéseit nézzük át.
- Az első és kihagyhatatlan lépés: az elektronikus személyi igazolványunk és az EESZT portálra bejelentkezéshez szükséges felhasználónév és jelszó! Ezek nélkül nem tudunk regisztrálni!
- Szükségünk lesz egy internetkapcsolattal és személyi igazolvány leolvasóval rendelkező munkaállomásra. Ez lehet szerver, vagy officinai munkaállomás.
- Android vagy iOS rendszerrel, internetkapcsolattal és kamerával rendelkező mobiltelefonra.
- Töltsük le és telepítsük a mobiltelefonunkra az EESZT MobilToken alkalmazást:
- Megtörténtek az előkészületek, készen állunk a regisztrációra. Lépjünk fel az általunk használni kívánt munkaállomásról a https://portal.eeszt.gov.hu/hu/bejelentkezes-eszig

- Helyezzük be az elektronikus személyi igazolványunkat a számítógép leolvasójába.
- A bejelentkezéshez adjuk meg az EESZT ágazati portáljának használatához szükséges felhasználói nevünket. Ez gyógyszerészek esetén: G és az alap nyilvántartási szám, a gyógyszertári szakasszisztenseknél: S és az alap nyilvántartási szám.
- A személyi igazolvány leolvasóján üssük be az EESZT bejelentkezéshez szükséges hatjegyű PIN kódot.
- A legördülő menüből válasszunk ki az egészségügyi intézményt. Annak a felhasználónak, aki több intézményben, szolgáltatónál is dolgozik, elég az egyiknél elvégeznie ezt a regisztrációt.

- A sikeres belépést követően a menüben kattintsunk a Mobilalkalmazások menüpontra.

- A jobb oldalon kattintsunk az Új regisztráció
- A regisztráció következő lépéséhez az EESZT MobilToken alkalmazásnak telepítve kell lennie a telefonunkra. Ha ez rendben van, akkor kattintsunk a Tovább

- Indítsuk el a telefonunkon az EESZT MobilToken alkalmazást, és adjuk meg az EESZT használatához szükséges felhasználónevünket. A Tovább a QR kód olvasásához gomb megnyomása után engedélyezzük az alkalmazás számára a készülék kamerájának használatát.
- A mobiltelefonunk kamerájával keressük meg a számítógép képernyőjén található QR kódot.

- Amennyiben valamilyen technikai probléma miatt nem sikerül a QR-kód lefényképezése, lehetőség van kódra váltani.
- A QR-kód beolvasását követően a telefonunk kijelzőjén egy kódot kapunk, melyet be kell gépelnünk a számítógépen az EESZT portáljára is. Ez csak a viszont-azonosításhoz szükséges, nem kell megjegyeznünk. Ha beírtuk, kattintsunk a Tovább gombra.
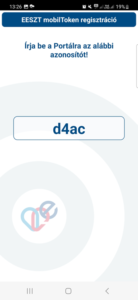

- A következő lépésben meg kell adnunk egy hatjegyű PIN kódot, melyet a telefonos applikációhoz fogunk használni.


- Ezzel a regisztrációt sikeresen befejeztük, kijelentkezhetünk a portálról.
Mobiltoken használata a patikai szoftverben
- A gyógyszertári szoftverben indítsuk el az officinai alkalmazást, és a bejelentkezési lehetőségeknél válasszuk ki az EESZT MobilToken használatát.
- Indítsuk el a mobiltelefonunkon az EESZT MobilToken alkalmazást. Gépeljük be a regisztráció során általunk korábban megadott hatjegyű PIN kódot. Ne lepődjünk meg, a számok minden alkalommal más sorrendben jelennek meg!
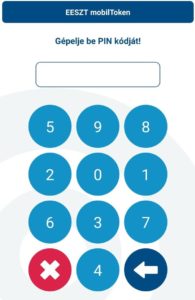
- Az alkalmazás által adott hatjegyű számot írjuk be a gyógyszertári program megfelelő mezőjébe, és lépjünk be az EESZT-be. Fontos! A generált hatszámjegyű kódot 60 másodpercen be kell írnunk. 60 másodperc után lejár, és újabb kódot kell kérnünk.
Szeretném felhívni a figyelmüket arra, hogy egy telefonkészülékhez csak egy felhasználói profilt lehet hozzákapcsolni, egy adott telefonnal csak egy ember tud bejelentkezni az EESZT-be, valamint egy felhasználónak csak egy telefonja lehet regisztrálva.
A regisztrált készülékkel történjen bármi – lopás, törés, az EESZT felületéről a regisztrációját törölni kell! Ameddig ez nem történik meg, a felhasználó nem tud új készüléket regisztrálni.
Amennyiben a regisztráció során bármilyen probléma adódik, vegye fel a kapcsolatot az EESZT Helpdeskkel az alábbi elérhetőségek egyikén:
Telefon: +36 1 920 1050
E-mail: helpdesk.eeszt@okfo.gov.hu
A gyógyszerészi gondozásról
A gyógyszerészi gondozásról
A Covid-19 pandémia rávilágított arra, hogy a gyógyszerészeknek milyen komoly szerepük van a járóbeteg ellátásban. De hogyan kapcsolódik ez a gyógyszertári ügyviteli szoftverekhez? Dr. Gyarmati Kinga gyógyszerészszakmai vezető írása.
A pandémia idején a világ számára világossá vált a gyógyszerészi gondozás súlya, szerepe és a gondozásra mutatkozó igény. Ezek meghatároztak egy kompetenciafejlesztési irányt is, amivel az egészségügyi ágazat vezetésének és a gyógyszerészi szakmának komolyan foglalkoznia kell.
A gyógyszerészi gondozás és annak irányelvei egy olyan jövőbe mutató rendszert képeznek, amelynek alap jogszabályi kerete már korábban meghatározásra került, és amely mögé, ha nem egy megfelelően kidolgozott dokumentációs infrastruktúra kerül kialakításra, nem validálható a gyógyszerészek valós tudása, amit a gyógyszerészi gondozás irányelvei tesznek bele, és nem teremthető meg a finanszírozhatóság lehetősége sem.
Mi is a gyógyszerészi gondozás?
A 2006.évi GYFTV 3§ (26) pontja kimondja, hogy a gyógyszerészi gondozás „a gyógyszerész által önként vállalt, felelősen végzett dokumentált tevékenység, melynek célja együttműködésben az orvossal a hatásos, biztonságos és költséghatékony gyógyszeres terápia elősegítésén túl, a beteg egészségtudatos életvitele kialakításának elősegítése, megfelelő gyógyszerhasználatának szakmai segítése, együttműködő készségének növelése, életminőségének javítása, minőségileg kontrollált körülmények között.”
A 41/2007 (IX.19.) EüM rendelet 36/A § (1) bekezdés c) pontjában ezt mondja: „a betegség-specifikus gyógyszerészi gondozás, mely a népegészségügyi programhoz kapcsolódóan az adott betegség és kockázati tényezői korai felismerésére, a betegség késői komplikációinak vagy visszatérésének megelőzésére, a betegek egyensúlyi állapotának fenntartására irányul és – a beteg kezelőorvosával együttműködésben – magában foglalja a kockázati tényezők felmérését és a beteg szükség szerinti orvoshoz irányítását, valamint a beteg oktatását és együttműködőkészségének kialakítását, továbbá a beteg gyógyszerhasználatának irányítását”
(3) pontja pedig kimondja: „Az (1) bekezdés c) pontjában meghatározott gyógyszerészi gondozási tevékenységet az a gyógyszerész végezheti, aki a külön jogszabály szerinti folyamatos továbbképzés keretében az erre irányuló programot elvégezte.”
Jogszabályok fölött a valóság
Jelenleg a gyógyszerészi gondozás egy önkéntes alapon működő tevékenység, amelynek törvényi háttere bár előírja a kötelező és megfelelő dokumentációját, de azt, hogy az milyen aktuális irányelvek szerint történjen, nem. Emellett az EüM rendelet (3) pontja szerint a gondozást olyan folyamatos továbbképzési rendszerhez köti, amely jelenleg nem létezik. A szakmai irányelvek pedig 2021. április 1-én lejártak, újbóli akkreditálásuk pedig nem történt meg.
A gyógyszerészi gondozás, valamint az új irányelvek meghatározása a 41/2007 (IX.19.) EüM rendeletben meghatározott gyógyszerészi szakmapolitikai és tudományos társaságok kompetenciája. A rendelet 36/A § (7) pontja kimondja, hogy „a gyógyszerészi gondozással kapcsolatos szakmai irányelveket az egészségügyi szakmai kollégium Gyógyszerellátási gyógyszerészet tagozata és tanácsa készíti elő és terjeszti fel közzétételre jogszabályban foglaltak alapján. A kollégium ezen irányelvek előkészítésébe bevonja a Magyar Gyógyszerészi Kamara, a Magyar Gyógyszerésztudományi Társaság és a Magángyógyszerészek Országos Szövetségének képviselőit, valamint az érintett orvosi tagozatokat és tanácsokat.”
A Pharma Cloud Kft. elkötelezett a gyógyszerészek és a gyógyszerész hivatás irányába. Szolgálatatásaival, valamint ügyviteli szoftverei, a daxa™ és QB-Pharma fejlesztéseivel folyamatosan a mindenkori jogszabályi környezet elvárásainak mentén szolgálja ki partnereit. Amennyiben a jogszabályi környezet pontosan meghatározza az irányelvek szerinti dokumentációs paramétereket, a patikai szoftverekben ezeknek megfelelően meg fognak jelenni.
Szerializáció – közös felelősség, közös munka a gyógyszerhamisítás ellen
Szerializáció – közös felelősség, közös munka a gyógyszerhamisítás ellen
A szerializáció egy EU-s szabályozási rendszer eleme, mely a gyógyszerellátási lánc szigorú ellenőrzésére és nyilvántartására szolgál, és amelyben a gyógyszerkereskedelem minden résztvevőjének fontos feladata van.
A szerializáció egy a gyógyszerhamisítás megelőzését megcélzó egyedi gyógyszerazonosítási rendszer, melynek segítségével egy adott készítmény a gyógyszergyártól egészen a patikáig nyomon követhetővé válik.
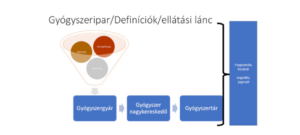
Mit is nevezünk hamis gyógyszernek?
2005. évi XCV. törvény az emberi alkalmazásra kerülő gyógyszerekről és egyéb, a gyógyszerpiacot szabályozó törvények módosításáról 1§ 42. pontja alapján hamisított gyógyszer: „bármilyen gyógyszer, amelynek eredete nem igazolható, vagy amellyel kapcsolatban – a nem szándékos minőségi hiányosság esetét kivéve – az alábbiak valamelyike hamisan van feltüntetve:
a) azonossága, így annak csomagolása és a címkézése, megnevezése, a hatóanyagokat, segédanyagokat és azok hatáserősségét jelölő összetétele,
b) eredete, így a gyártója, a gyártó országa, a származási országa vagy a forgalomba hozatali engedély jogosultja,
c) előtörténete, így az alkalmazott forgalmazási lánc azonosítását lehetővé tevő nyilvántartások és dokumentumok;
függetlenül attól, hogy ez sérti-e a szellemi tulajdonjogot”
A patikákban kapható vényköteles gyógyszerek dobozait az új szabályok értelmében egyedi biztonsági elemekkel látják el. Az uniós szabályok szerint két biztonsági elemet kell elhelyezniük a gyógyszergyártóknak a vényköteles készítmények csomagolásán. Az egyik egy kétdimenziós adatmátrixkód, amely a gyógyszerek egyedi dobozazonosítóját tartalmazza, a másik pedig a manipulálás ellen védő, dézsmabiztos csomagolás. A szabályozás értelmében a gyógyszerek csak akkor adhatók ki a gyógyszertárakban a betegeknek, ha mindkét biztonsági elem megfelelő és sértetlen a csomagoláson.
Magyarországon is kötelező
A hamisított gyógyszerekről szóló irányelv által bevezetett gyógyszer-azonosítási szabályokat 2019. február 9-től kötelezően alkalmazni kell az EU és az EGT területén. Magyarországon a HUMVO Zrt. a gyógyszer-azonosító rendszer működtetője. A szervezet alapvető feladata a nemzeti gyógyszer-verifikációs rendszer (NMVS) létrehozása és működtetése a vonatkozó EU direktívának való megfelelés szerint.
Magyarországon a rendszer – az OGYÉI döntése alapján – több lépésben, fokozatosan került bevezetésre, 2023. február 9-től pedig már élesben, a rendszerben keletkező riasztások esetén az alábbiak szerint kell eljárni.
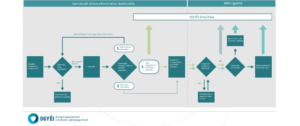
Mi történik, amikor deaktiválás során riasztás történik?
A gyógyszertárakban a gyógyszer biztonsági elemeit, mint végponton lévő a lakossági gyógyszerellátásra engedéllyel rendelkezőknek vagy arra jogosult személyeknek (gyógyszerészek) kötelező ellenőrizni.
A gyógyszertárak riasztás esetén nem adhatják ki a körülmények kivizsgálása – és a gyógyszertár belső eljárásrendje szerinti dokumentálás – nélkül azokat a gyógyszereket, amelyekre vonatkozóan a patikai szoftverben az alábbi táblázatban felsorolt rendszerüzenetek érkeznek:
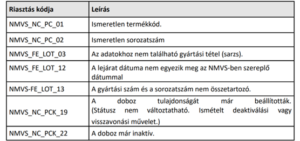
Riasztás esetén:
- Amennyiben az emberi tévedés vagy technikai hiba kizárható (pl. többször megismételt deaktiválási kísérlet, korábbi téves deaktiválás, rosszul beállított leolvasó), és a hamisítás gyanúja megalapozottan felmerül, az érintett gyógyszert karanténba kell helyezni a rendszer által adott riasztási azonosító (Alert ID) egyidejű rögzítésével, és bejelentést kötelező tenni az OGYÉI-részére bármilyen formában, de elsődlegesen a szerializacio@ogyei.gov.hu címre küldött elektronikus levélben. Kérjük, hogy a levél tárgyában szerepeljen a „riasztás kivizsgálás” kifejezés is.
- Amennyiben az emberi tévedés vagy technikai hiba igazolható és a hamisítás megalapozott gyanúja nem merül fel, akkor – a gyógyszertár belső eljárásrendje szerinti dokumentálás után – a gyógyszer kiadható.
Forrás: OGYÉI
Szerializáció – lejár a stabilizációs időszak
Szerializáció – lejár a stabilizációs időszak
2023. február 9-én véget ér az az átmeneti időszak, mely a gyógyszerek eredetiségét szavatoló ellenőrzési rendszer elindítására és a végponti ellenőrzésekre történő átállásra szolgált a 2019. február 9-én Magyarországon lépett életbe EU-rendelet nyomán. Cikkünkben összegyűjtöttük a patikák számára legfontosabb tudnivalókat a gyógyszerbiztonságot érintő napi feladatokról.
Az Európai Parlament és a Tanács 2011/62/EU irányelve felhatalmazta az Európai Bizottságot, hogy az intézkedéseket hozzon a gyógyszerek eredetiségének ellenőrzésére és a gyógyszerösszetevők minőségének javítására. Az ennek nyomán a Bizottság EU 2016/161 felhatalmazáson alapuló rendeletében foglaltak szerint 2019. február 9-től Magyarországon is minden végponti felhasználónak ellenőriznie kell a gyógyszerek eredetiségét. A gyógyszerek eredetiségét egy végponttól végpontig típusú ellenőrzési rendszer szavatolja, amelyet a gyógyszerek kockázatától függően a nagykereskedők általi ellenőrzések egészítenek ki. Ez egy EU-szintű adattároló rendszer, a European Medicines Verification System (EMVS), melyet a European Medicines Verification Organisation (EMVO) működtet. A szabályozás értelmében ehhez az informatikai rendszerhez minden EU-tagországnak létre kellett hoznia a saját nemzeti szervezetét.
A HUMVO
A magyarországi gyógyszerellátási lánc szereplői: gyógyszergyártók, gyógyszergyári képviseletek, gyógyszer-nagykereskedők, valamint gyógyszerészek képviselete 2017. július 10-én megalapították a HUMVO-t, a Magyarországi Gyógyszer-azonosítási Nonprofit Zártkörűen Működő Részvénytársaságot, melynek célja a vonatkozó EU előírásoknak való megfelelés, alapvető feladata pedig a nemzeti gyógyszer-verifikációs rendszer (NMVS) létrehozása és működtetése.
A HUMVO Nonprofit Zrt. részvényesei a Generikus Gyógyszergyártók és Forgalmazók Magyarországi Érdekvédelmi Egyesülete, a Gyógyszer-nagykereskedők Szövetsége, az Innovatív Gyógyszergyártók Egyesülete, a Magyar Gyógyszerészi Kamara, a Magyarországi Gyógyszergyártók Országos Szövetsége és a „VÉDETTSÉG” Oltóanyag és Immunbiológiai Termék Gyártók és Forgalmazók Egyesülete.
Az Adattároló Rendszer
A szervezet alapvető feladata a Nemzeti Gyógyszer Verifikációs Adattároló Rendszer (röviden: NMVS) létrehozása és működtetése. Az Adattároló Rendszer fő felhasználói a lakossági gyógyszerellátásra engedéllyel rendelkező vagy arra jogosult személyek (gyógyszerészek), valamint a gyógyszer-nagykereskedők.
Az Adattároló Rendszer fő funkciója, hogy azonosítási platformként szolgáljon az arra feljogosított személyeknek annak érdekében, hogy az EU Rendeletben leírtak szerint ellenőrizni tudják a gyógyszer biztonsági elemeit:
- a csomagoláson található egyedi azonosítót összehasonlítják az adattároló rendszerben tárolt azonosítókkal
- deaktiválják a gyógyszer egyedi azonosítóját
- ellenőrzik a manipulálás elleni eszköz sértetlenségét
A gyógyszertárak feladatai
A hamisított gyógyszerekről szóló irányelv a gyógyszer eredetiségének vizsgálata céljából két biztonsági elemet vezetett be: egy egyedi azonosítót és egy manipulálás elleni eszközt. Ezek az elemek a betegek védelmét szolgálják a hamisított gyógyszerek veszélyeivel és a téves gyógyszerkiadással szemben.
A bevezetett gyógyszer-azonosítási szabályokat 2019. február 9-től kötelezően alkalmazni kell az EU és az EGT területén. Magyarországon a rendszer ettől az időponttól, az OGYÉI döntése alapján, több lépésben, fokozatosan került bevezetésre, az Intézet 2023. február 9-ig határozott meg egy stabilizációs időszakot a hazai gyógyszerbiztonsági rendszer működésének elindítására.
Ez a stabilizációs időszak 2023. február 9-én lejár. A gyógyszertárakban, mint végponton lévő, a lakossági gyógyszerellátásra engedéllyel rendelkezőknek vagy arra jogosult személyeknek (gyógyszerészek) továbbra is, ahogy eddig kötelező ellenőrizni a gyógyszer biztonsági elemeit, és a HUMVO Adattároló Rendszerében deaktiválni minden eladott gyógyszer egyedi dobozazonosítóját.
Február 9-től a keletkező riasztások esetén pedig az alábbiak szerint kötelező eljárni:
- Nem adhatók ki a körülmények kivizsgálása és a gyógyszertár belső eljárásrendje szerinti dokumentálás nélkül azok a gyógyszerek, amelyekre vonatkozóan az alábbi táblázatban szereplő rendszerüzenetek érkeznek a rendszerben:

- Amennyiben az emberi tévedés vagy technikai hiba kizárható (pld. többször megismételt deaktiválási kísérlet, korábbi téves deaktiválás, rosszul beállított leolvasó), és a hamisítás gyanúja megalapozottan felmerül, az érintett gyógyszert karanténba kell helyezni a rendszer által adott riasztási azonosító (Alert ID) egyidejű rögzítésével, és bejelentést kell tenni az OGYÉI-részére bármilyen formában, de elsődlegesen a szerializacio@ogyei.gov.hu címre küldött elektronikus levélben. A levél tárgyában a „riasztás kivizsgálás” kifejezést kell feltüntetni.
- Amennyiben emberi tévedés vagy technikai hiba okozta a riasztást, és a hamisítás megalapozott gyanúja nem merül fel, abban az esetben, a gyógyszertár belső eljárásrendje szerinti dokumentálást követően a gyógyszer kiadható.
Az OGYÉI ellenőrzési jogköre
Az EU 2016/161 felhatalmazáson alapuló rendeletében előírt kötelezettségek teljesítésének ellenőrzésére kijelölt illetékes nemzeti hatóság az Országos Gyógyszerészeti és Élelmezés-egészségügyi Intézet. A gyógyszertárak tekintetében az OGYÉI Tisztigyógyszerészeti főosztálya jogosult ellenőrizni az előírások szerinti működést.
Forrás: OGYÉI, HUMVO Zrt.
Amit az eGYSE vényekkel kapcsolatos feladatokról tudni kell
Amit az eGYSE vényekkel kapcsolatos feladatokról tudni kell
Cikkünkben összefoglalva átadjuk azokat a legfontosabb információkat, melyeket az elektronikus gyógyászati segédeszköz vények kiadásával kapcsolatban minden expediáló számára fontos tudni.
2021. november 1-vel Magyarországon bevezetésre került az EESZT eGYSE modulja, azaz a 27-s vonalkódú eGYSE recept. A bevezetést követően átmeneti időszak vette kezdetét, amely engedélyezte az eRecept modulban történő gyógyászati segédeszköz felírást és kiváltást. Ez az átmeneti időszak 2022. október 31-én lejárt.
 2022. november 1-től az orvosi szoftverekben gyógyászati segédeszközt elektronikus formában kizárólag a 27-es modulban, az eGYSE-ként lehet felírni. 2023. január 28. után kizárólag az e modulban felírt elektronikus receptek számolhatók el a NEAK felé. Ugyanakkor, miután a gyógyászati segédeszköz vények kiválthatósága 90 nap, így a 2022. november 1. előtt 22-es eRecept modulban felírt gyógyászati segédeszköz elektronikus vényei 2023. január 28-ig kiadhatóak.
2022. november 1-től az orvosi szoftverekben gyógyászati segédeszközt elektronikus formában kizárólag a 27-es modulban, az eGYSE-ként lehet felírni. 2023. január 28. után kizárólag az e modulban felírt elektronikus receptek számolhatók el a NEAK felé. Ugyanakkor, miután a gyógyászati segédeszköz vények kiválthatósága 90 nap, így a 2022. november 1. előtt 22-es eRecept modulban felírt gyógyászati segédeszköz elektronikus vényei 2023. január 28-ig kiadhatóak.
Az expediálók feladatai
Amennyiben expediálás során 22-s eRecepten felírt gyógyászati segédeszköz vényt akarnak kiadni, a felírás időpontját ellenőrizni kell, továbbá a gyógyászati segédeszköz expediálása során a kiadónak ellenőriznie kell a kihordási időre felírt mennyiséget. Kivételes, méltányossági (többletmennyiség) kivételével nem adható ki több, a felírhatóságon túli mennyiség.
Nem az expediálók feladata
Ahogy az eVényeknél, úgy az eGySE vények esetén sem feladata gyógyszertáraknak a betegek TB jogviszony-ellenőrzése. A hatályos jogszabály szerint a felírás pillanatában a felíró orvos kizárólagos kompetenciája a TAJ-szám érvényességének ellenőrzése.
Szintén nem az expediálók felelőssége az orvosi pecsétszám, a beteg beleegyező nyilatkozatának megléte, továbbá szakorvosi javaslatok meglétének, illetve azok lejárati idejének ellenőrzése. Ezek ellenőrzése szintén az orvosi felíró feladata.
Összefoglalva: az eGySE (27) felírása során a patika kötelezően elvégzendő feladata a kihordási időre történő felírt darabszám ellenőrzése.
Gyógyászati segédeszközök árazása
GYÓGYSZERÉSZ SZAKMAI
INFORMÁCIÓK
Gyógyászati segédeszközök árazása
A társadalombiztosítási támogatás alá eső gyógyászati segédeszközök árazásakor a NEAK Ártámogatási Főosztályának állásfoglalása szerint az alábbi szempontokat szükséges figyelembe venni:
A társadalombiztosítás alá eső gyógyászati segédeszközök értékesítésére vonatkozó jogszabályi hátteret a 2006. évi XCVIII törvény 35.§ szolgáltatja:
(2) * A gyógyászati segédeszköz forgalmazója a társadalombiztosítási támogatással történő kiszolgáltatás során az egészségbiztosítási szerv által a támogatás megállapítására irányuló eljárásban
- a) a közfinanszírozás alapjául elfogadott árnál alacsonyabb és a b) pontban foglalt kivételtől eltekintve magasabb áron nem értékesítheti az adott eszközt,
- b) a közfinanszírozás alapjául elfogadott árnál a miniszteri rendeletben foglalt eszközcsoportok esetében legfeljebb 5%-kal magasabb áron értékesítheti az adott eszközt,
- c) megállapított támogatási összegtől sem közvetlenül, sem pedig közvetett módon nem térhet el,
- d) megállapított térítési díjtól a b) pontban foglaltaknak megfelelően térhet el.
A NEAK által kiadott állásfoglalás szerint: az a) és b) pontok értelmezésében a társadalombiztosítási támogatással történő értékesítés során a közfinanszírozás alapjául elfogadott árnál alacsonyabb és a b) pontban foglalt kivételtől eltekintve magasabb áron a gyógyszertár nem értékesítheti az adott eszközt, hozzátéve, hogy mivel jelenleg nincs olyan érvényben lévő miniszteri rendelet, amely felsorolja az eltérő áron értékesíthető eszközöket, így a gyógyszertárak számára jelenleg semmilyen eszközcsoport esetében sincs jogszabályi lehetőség a tb. támogatott ártól való eltérésre.
Abban az esetben azonban, ha a gyógyszertár kézi eladás során értékesíti ugyanezen eszközöket, lehetősége nyílik a szabad árképzésre. A gyógyászati segédeszközök vény nélküli értékesítése nem minősül társadalombiztosítási támogatással történő kiszolgáltatásnak, a közfinanszírozás alapját képező ártól való eltérés tilalma így erre nem vonatkozik.
Mind a QB-Pharma, mind a daxa™ patikai szoftverek beállítása a fenti jogszabályi elvárásoknak megfelelő.
Dr. Gyarmati Kinga
gyógyszerészszakmai vezető
NEAK-állásfoglalás a glükóz szenzorok helyettesíthetőségéről
GYÓGYSZERÉSZ SZAKMAI
INFORMÁCIÓK
NEAK-állásfoglalás a glükóz szenzorok helyettesíthetőségéről
Az alábbiakban adjuk közre a glükóz szenzorok helyettesíthetősége és kompatibilitása kapcsán a NEAK Ártámogatási Főosztálya által adott állásfoglalást:
„A 14/2007. (III. 14.) EüM rendelet ISO-kódok szintjén az „azonos rendeltetésű eszközcsoport”-ot nevesíti, ami ISO8 szintet jelent. Ezen az ISO szinten belül „funkcionálisan egyenértékű” eszközzel történhet a helyettesítés. A funkcionálisan egyenértékű eszköz azonban nem feleltethető meg az ISO10 szint „funkcionális csoport” definíciójának. A funkcionális csoportok (ISO10) a támogatási paraméterek (indikáció, támogatási mérték, felírható mennyiség, kihordási idő stb.) azonos meghatározása érdekében kerültek kialakításra, nem a szakmai és kompatibilitási helyettesíthetőség megállapítására.”
Fentiek értelmében tehát a glükóz szenzorok, bár ISO10 szint szerint egy funkcionális csoportba tartozók, nem helyettesíthetők egymással.
Bármely egyéb tartozék termékkörben is találhatunk példát, ahol csoporton belül nem feltétlenül helyettesíthető az összes többi eszközzel a rendelt termék. Néhány példa ezekre:
- kompatibilitás miatt: CPAP készülékekhez tartozó párásítók és maszkok, inzulinpumpa szerelékek, hallókészülék elemek, kerekesszék akkumulátorok
- eltérő méretezés miatt: kötszerek, szemtakarók, sztómazsák, katéterek, nadrágpelenkák (L és XL méretűek azonos funkcionális csoportban), könyökmankók (felnőtt és gyermek méretek azonos csoportban)
- egyéb tulajdonságaikban eltérő eszközök: csonkharisnyák (eltérő kompressziós fokozatuk okán) stb.
Dr. Gyarmati Kinga
gyógyszerészszakmai vezető
2022. október 7.
November 1-től változik a GYSE vények felírása és kiadása
GYÓGYSZERÉSZ SZAKMAI
INFORMÁCIÓK
November 1-től változik a GYSE vények felírása és kiadása
Az OKFŐ által kiadott tájékoztatás alapján az alábbiakban szeretnénk felhívni figyelmüket a GYSE vények kiváltását és NEAK-elszámolását érintő legfontosabb változásokra.
A tavaly életbe lépett 32/2021. (VII. 29.) EMMI rendelethez kapcsolódóan – mely rendelet bevezette az eGYSE recept modult – az EESZT a gyógyászati segédeszközellátás folyamatosságának biztosítása érdekében 2021. november 1-től átmeneti időszakra engedélyezte a GYSE vények eRecept modulban történő felírását és kiváltását. Ez az átmeneti időszak 2022. október 31-én lejár.
2022. november 1-től az orvosi szoftverekben GYSE vényeket kizárólag a 27-es modulban, az eGYSE alatt lehet felírni, és 2023.január 28. után a kizárólag az e modulban felírt receptek elszámolhatók a NEAK felé.
A gyógyszertárak a 22-es azonosítóval az eRecept rendszerben felírt GYSE vényeket abban az esetben adhatják ki és számolhatják el, amennyiben az 2022. október 31-ig került felírásra. Az október 31.-ig felírt vények kiadhatósági ideje: 2023. január 28.
A 2022. november 1-től felírt GYSE vények kizárólag a 27-es azonosító alatt az eGYSE modulban történő beküldés esetén adhatók ki és számolhatók el a NEAK felé.
Dr. Gyarmati Kinga
gyógyszerészszakmai vezető

