Szerializáció – közös felelősség, közös munka a gyógyszerhamisítás ellen
A szerializáció egy EU-s szabályozási rendszer eleme, mely a gyógyszerellátási lánc szigorú ellenőrzésére és nyilvántartására szolgál, és amelyben a gyógyszerkereskedelem minden résztvevőjének fontos feladata van.
A szerializáció egy a gyógyszerhamisítás megelőzését megcélzó egyedi gyógyszerazonosítási rendszer, melynek segítségével egy adott készítmény a gyógyszergyártól egészen a patikáig nyomon követhetővé válik.
Mit is nevezünk hamis gyógyszernek?
2005. évi XCV. törvény az emberi alkalmazásra kerülő gyógyszerekről és egyéb, a gyógyszerpiacot szabályozó törvények módosításáról 1§ 42. pontja alapján hamisított gyógyszer: „bármilyen gyógyszer, amelynek eredete nem igazolható, vagy amellyel kapcsolatban – a nem szándékos minőségi hiányosság esetét kivéve – az alábbiak valamelyike hamisan van feltüntetve:
a) azonossága, így annak csomagolása és a címkézése, megnevezése, a hatóanyagokat, segédanyagokat és azok hatáserősségét jelölő összetétele,
b) eredete, így a gyártója, a gyártó országa, a származási országa vagy a forgalomba hozatali engedély jogosultja,
c) előtörténete, így az alkalmazott forgalmazási lánc azonosítását lehetővé tevő nyilvántartások és dokumentumok;
függetlenül attól, hogy ez sérti-e a szellemi tulajdonjogot”
A patikákban kapható vényköteles gyógyszerek dobozait az új szabályok értelmében egyedi biztonsági elemekkel látják el. Az uniós szabályok szerint két biztonsági elemet kell elhelyezniük a gyógyszergyártóknak a vényköteles készítmények csomagolásán. Az egyik egy kétdimenziós adatmátrixkód, amely a gyógyszerek egyedi dobozazonosítóját tartalmazza, a másik pedig a manipulálás ellen védő, dézsmabiztos csomagolás. A szabályozás értelmében a gyógyszerek csak akkor adhatók ki a gyógyszertárakban a betegeknek, ha mindkét biztonsági elem megfelelő és sértetlen a csomagoláson.
Magyarországon is kötelező
A hamisított gyógyszerekről szóló irányelv által bevezetett gyógyszer-azonosítási szabályokat 2019. február 9-től kötelezően alkalmazni kell az EU és az EGT területén. Magyarországon a HUMVO Zrt. a gyógyszer-azonosító rendszer működtetője. A szervezet alapvető feladata a nemzeti gyógyszer-verifikációs rendszer (NMVS) létrehozása és működtetése a vonatkozó EU direktívának való megfelelés szerint.
Magyarországon a rendszer – az OGYÉI döntése alapján – több lépésben, fokozatosan került bevezetésre, 2023. február 9-től pedig már élesben, a rendszerben keletkező riasztások esetén az alábbiak szerint kell eljárni.
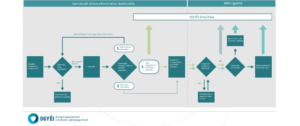
Mi történik, amikor deaktiválás során riasztás történik?
A gyógyszertárakban a gyógyszer biztonsági elemeit, mint végponton lévő a lakossági gyógyszerellátásra engedéllyel rendelkezőknek vagy arra jogosult személyeknek (gyógyszerészek) kötelező ellenőrizni.
A gyógyszertárak riasztás esetén nem adhatják ki a körülmények kivizsgálása – és a gyógyszertár belső eljárásrendje szerinti dokumentálás – nélkül azokat a gyógyszereket, amelyekre vonatkozóan a patikai szoftverben az alábbi táblázatban felsorolt rendszerüzenetek érkeznek:
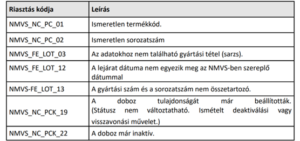
Riasztás esetén:
- Amennyiben az emberi tévedés vagy technikai hiba kizárható (pl. többször megismételt deaktiválási kísérlet, korábbi téves deaktiválás, rosszul beállított leolvasó), és a hamisítás gyanúja megalapozottan felmerül, az érintett gyógyszert karanténba kell helyezni a rendszer által adott riasztási azonosító (Alert ID) egyidejű rögzítésével, és bejelentést kötelező tenni az OGYÉI-részére bármilyen formában, de elsődlegesen a szerializacio@ogyei.gov.hu címre küldött elektronikus levélben. Kérjük, hogy a levél tárgyában szerepeljen a „riasztás kivizsgálás” kifejezés is.
- Amennyiben az emberi tévedés vagy technikai hiba igazolható és a hamisítás megalapozott gyanúja nem merül fel, akkor – a gyógyszertár belső eljárásrendje szerinti dokumentálás után – a gyógyszer kiadható.
Forrás: OGYÉI

