Szerializáció – lejár a stabilizációs időszak
2023. február 9-én véget ér az az átmeneti időszak, mely a gyógyszerek eredetiségét szavatoló ellenőrzési rendszer elindítására és a végponti ellenőrzésekre történő átállásra szolgált a 2019. február 9-én Magyarországon lépett életbe EU-rendelet nyomán. Cikkünkben összegyűjtöttük a patikák számára legfontosabb tudnivalókat a gyógyszerbiztonságot érintő napi feladatokról.
Az Európai Parlament és a Tanács 2011/62/EU irányelve felhatalmazta az Európai Bizottságot, hogy az intézkedéseket hozzon a gyógyszerek eredetiségének ellenőrzésére és a gyógyszerösszetevők minőségének javítására. Az ennek nyomán a Bizottság EU 2016/161 felhatalmazáson alapuló rendeletében foglaltak szerint 2019. február 9-től Magyarországon is minden végponti felhasználónak ellenőriznie kell a gyógyszerek eredetiségét. A gyógyszerek eredetiségét egy végponttól végpontig típusú ellenőrzési rendszer szavatolja, amelyet a gyógyszerek kockázatától függően a nagykereskedők általi ellenőrzések egészítenek ki. Ez egy EU-szintű adattároló rendszer, a European Medicines Verification System (EMVS), melyet a European Medicines Verification Organisation (EMVO) működtet. A szabályozás értelmében ehhez az informatikai rendszerhez minden EU-tagországnak létre kellett hoznia a saját nemzeti szervezetét.
A HUMVO
A magyarországi gyógyszerellátási lánc szereplői: gyógyszergyártók, gyógyszergyári képviseletek, gyógyszer-nagykereskedők, valamint gyógyszerészek képviselete 2017. július 10-én megalapították a HUMVO-t, a Magyarországi Gyógyszer-azonosítási Nonprofit Zártkörűen Működő Részvénytársaságot, melynek célja a vonatkozó EU előírásoknak való megfelelés, alapvető feladata pedig a nemzeti gyógyszer-verifikációs rendszer (NMVS) létrehozása és működtetése.
A HUMVO Nonprofit Zrt. részvényesei a Generikus Gyógyszergyártók és Forgalmazók Magyarországi Érdekvédelmi Egyesülete, a Gyógyszer-nagykereskedők Szövetsége, az Innovatív Gyógyszergyártók Egyesülete, a Magyar Gyógyszerészi Kamara, a Magyarországi Gyógyszergyártók Országos Szövetsége és a „VÉDETTSÉG” Oltóanyag és Immunbiológiai Termék Gyártók és Forgalmazók Egyesülete.
Az Adattároló Rendszer
A szervezet alapvető feladata a Nemzeti Gyógyszer Verifikációs Adattároló Rendszer (röviden: NMVS) létrehozása és működtetése. Az Adattároló Rendszer fő felhasználói a lakossági gyógyszerellátásra engedéllyel rendelkező vagy arra jogosult személyek (gyógyszerészek), valamint a gyógyszer-nagykereskedők.
Az Adattároló Rendszer fő funkciója, hogy azonosítási platformként szolgáljon az arra feljogosított személyeknek annak érdekében, hogy az EU Rendeletben leírtak szerint ellenőrizni tudják a gyógyszer biztonsági elemeit:
- a csomagoláson található egyedi azonosítót összehasonlítják az adattároló rendszerben tárolt azonosítókkal
- deaktiválják a gyógyszer egyedi azonosítóját
- ellenőrzik a manipulálás elleni eszköz sértetlenségét
A gyógyszertárak feladatai
A hamisított gyógyszerekről szóló irányelv a gyógyszer eredetiségének vizsgálata céljából két biztonsági elemet vezetett be: egy egyedi azonosítót és egy manipulálás elleni eszközt. Ezek az elemek a betegek védelmét szolgálják a hamisított gyógyszerek veszélyeivel és a téves gyógyszerkiadással szemben.
A bevezetett gyógyszer-azonosítási szabályokat 2019. február 9-től kötelezően alkalmazni kell az EU és az EGT területén. Magyarországon a rendszer ettől az időponttól, az OGYÉI döntése alapján, több lépésben, fokozatosan került bevezetésre, az Intézet 2023. február 9-ig határozott meg egy stabilizációs időszakot a hazai gyógyszerbiztonsági rendszer működésének elindítására.
Ez a stabilizációs időszak 2023. február 9-én lejár. A gyógyszertárakban, mint végponton lévő, a lakossági gyógyszerellátásra engedéllyel rendelkezőknek vagy arra jogosult személyeknek (gyógyszerészek) továbbra is, ahogy eddig kötelező ellenőrizni a gyógyszer biztonsági elemeit, és a HUMVO Adattároló Rendszerében deaktiválni minden eladott gyógyszer egyedi dobozazonosítóját.
Február 9-től a keletkező riasztások esetén pedig az alábbiak szerint kötelező eljárni:
- Nem adhatók ki a körülmények kivizsgálása és a gyógyszertár belső eljárásrendje szerinti dokumentálás nélkül azok a gyógyszerek, amelyekre vonatkozóan az alábbi táblázatban szereplő rendszerüzenetek érkeznek a rendszerben:
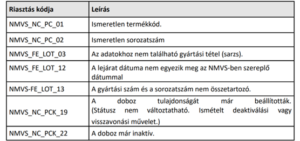
- Amennyiben az emberi tévedés vagy technikai hiba kizárható (pld. többször megismételt deaktiválási kísérlet, korábbi téves deaktiválás, rosszul beállított leolvasó), és a hamisítás gyanúja megalapozottan felmerül, az érintett gyógyszert karanténba kell helyezni a rendszer által adott riasztási azonosító (Alert ID) egyidejű rögzítésével, és bejelentést kell tenni az OGYÉI-részére bármilyen formában, de elsődlegesen a szerializacio@ogyei.gov.hu címre küldött elektronikus levélben. A levél tárgyában a „riasztás kivizsgálás” kifejezést kell feltüntetni.
- Amennyiben emberi tévedés vagy technikai hiba okozta a riasztást, és a hamisítás megalapozott gyanúja nem merül fel, abban az esetben, a gyógyszertár belső eljárásrendje szerinti dokumentálást követően a gyógyszer kiadható.
Az OGYÉI ellenőrzési jogköre
Az EU 2016/161 felhatalmazáson alapuló rendeletében előírt kötelezettségek teljesítésének ellenőrzésére kijelölt illetékes nemzeti hatóság az Országos Gyógyszerészeti és Élelmezés-egészségügyi Intézet. A gyógyszertárak tekintetében az OGYÉI Tisztigyógyszerészeti főosztálya jogosult ellenőrizni az előírások szerinti működést.

