Ellenőrzött szerek kezelése
Ellenőrzött szerek kezelése
A napi expediálásban előforduló ellenőrzött szerek kezelésével kapcsolatban dr. Gyarmati Kinga gyógyszerészszakmai vezető készített fontos összefoglalót.
 Beszéljünk egy kicsit az ellenőrzött szerekkel történő patikai eljárásrendről. Ebben a cikkben a nagy általánosságban a napi szintű gyakorlatban előforduló esetek alapján a felírást, a kiadást és a rendelést járom körbe.
Beszéljünk egy kicsit az ellenőrzött szerekkel történő patikai eljárásrendről. Ebben a cikkben a nagy általánosságban a napi szintű gyakorlatban előforduló esetek alapján a felírást, a kiadást és a rendelést járom körbe.
Az elsődleges jogszabályi hátteret a 43/2005. (X. 15.) EüM rendelet – a fokozottan ellenőrzött szernek minősülő gyógyszerek orvosi rendelésének, gyógyszertári forgalmazásának, egészségügyi szolgáltatóknál történő felhasználásának, nyilvántartásának és tárolásának rendjéről – adja.
Mit nevezünk fokozottan ellenőrzött szernek? Melyek azok az alapanyagok, illetve készítmények, amelyek ezen rendelet alá tartoznak?
– A kábítószer és pszichotróp anyag: az ellenőrzött anyagokról szóló 78/2022. (XII. 28.) BM rendelet (a továbbiakban: BM rendelet) 1. melléklet K1 és K2 jegyzékén, a BM rendelet 2. melléklet P2, P3 és P4 jegyzékén szereplő anyagok gyógyszeralapanyagként, valamint az ezeket az anyagokat tartalmazó gyógyszerek, kivéve a BM rendelet 1. melléklet K3 jegyzékén szereplő anyagokkal megegyező összetételű gyógyszereket;
– A fokozottan ellenőrzött szer: a BM rendelet 1. melléklet K1 és K2 jegyzékén, a BM rendelet 2. melléklet P2 jegyzékén szereplő anyagok gyógyszeralapanyagként, valamint az ezeket az anyagokat tartalmazó gyógyszerek.
Részletesebben: https://net.jogtar.hu/jogszabaly?docid=a2200078.bm
Felírásra vonatkozó szabály
Ezek a készítmények mind elektronikusan (22-es eRecept), mind papír alapon (21-es) felírhatóak. Ezt azért emelem ki, mert a két típusú felírás között eltérőek a kötelező alaki kellékek.
- A 22-s eRecept esetén kötelezően látszódnia kell a TÉR-ben:
- a készítmény hatáserősségének arab számmal feltüntetve (pld.: DUROGESIC 25 µg/óra transzdermális tapasz)
- adagolási egységben (pld.: tabletta, ampulla, tapasz stb.) kifejezett adagjának római számmal, latin nyelven kiírva. Minden esetben bontásban, darabszámra kötelező felírni! (pld.: V.quinque)
- adagolására vonatkozó utasításnak, melyet egyértelműen kell megadni (pld.: 3 naponta 1 tapasz)
Amennyiben az expediáló kollégák hibát tapasztalnak a TÉR-ben felírt eRecept esetén, minél hamarabb fel kell venni a felíró orvossal a kapcsolatot a javítás miatt. Hibásan felírt eReceptet tilos expediálni!
- A 21-es, papír alapú recept esetén a következő alaki kellékek kötelezőek:
- a készítmény hatáserőssége arab számmal és latin nyelven feltüntetve (pld.: DUROGESIC 25 µg, viginti quinque µg /óra transzdermális tapasz)
- adagolási egységben (pld.: tabletta, ampulla, tapasz stb.) kifejezett adag római számmal, latin nyelven kiírva. Minden esetben bontásban, darabszámra kötelező felírni! (pld.: V.quinque)
- adagolására vonatkozó utasítás, melyet egyértelműen kell megadni (pld.: 3 naponta 1 tapasz)
Mindkét típusú felírás esetén, amennyiben az orvos magisztrális készítményt rendel, kötelező
- a gyógyszerben foglalt fokozottan ellenőrzött szer mennyiségét arab számmal és latinul, az adagok számát római számmal és betűvel, latin nyelven feltüntetni
- adagolására vonatkozó utasítást egyértelműen megadni
Kiadásra vonatkozó szabály
A vény patikába történő beérkezésekor ellenőrizzük, hogy mikor lett a vény felírva. Ellenőrizzük, hogy a vényre felírt gyógyszert a beteg először kapja-e, vagyis úgynevezett első felírás, vagy Értesítővel érkező, folyamatos, fokozottan ellenőrzött szerrel történő kezelés alatt álló beteg részére történt-e a felírás.
Az első recept felírása szakorvos által történhet. A beteget 15 napra látja el gyógyszerrel. Az adott készítmény ismételt felírása ezek után vagy a háziorvos, vagy a szakorvos kompetenciája, utóbbi abban az esetben, ha az adott gyógyszert kizárólag szakorvos rendelheti.
Mind az eRecept, mind a papír vény esetén a felírás után 5 munkanap a határidő, ami alatt a vény kiváltható. Ezt követően lejárt vényként kell kezelni.
- Értesítő általi kiadás
Az Értesítőt a háziorvos állítja ki. Az Értesítő meghatározza a kiadás gyakoriságát, de azt úgy kell meghatározni, hogy a felírt mennyiségű fokozottan ellenőrzött szer adagja a 30 napot ne haladja meg.
Ha az orvos a fokozottan ellenőrzött szerrel kapcsolatban a terápiában változtatást hajt végre, kötelező új Értesítőt kiállítania.
Az Értesítő alapján csak abban a patikában szabad kiadni a fokozottan ellenőrzött szert, amelyik patikára szól! Amennyiben a gyógyszertár működésében változás történik, például bezár, akkor erről kötelező értesíteni a beteget vagy hozzátartozót, és átadni a legközelebbi gyógyszertár részére az eredeti gyógyszertár által lepecsételt Értesítőt, az átadás tényét pedig szükséges bejelenteni az NNGYK felé.
- Helyettesíthetőség
Kardinális kérdés a helyettesítés. Helyettesíteni ezeket a készítményeket ugyanúgy lehet, mint bármelyik másik gyógyszert. Amennyiben az adott készítmény nem beszerezhető, és az NNGYK helyettesítési listáján szerepel helyettesítő készítmény, nyugodtan felajánlhatjuk.
Egy speciális szabály van azonban: az Értesítő másolatán a helyettesítést feltüntetve, az orvoshoz az Értesítőt vissza kell juttatni.
Rendelésre, visszavételre, visszárura vonatkozó szabály
Az adminisztrációt minden fent leírt esetben az 5 példányos kábítószer és pszichotróp megrendelő tömbben kell elvégezni.

Megrendelés során a megrendelendő gyógyszer nevét, hatáserősségét és a megrendelendő mennyiséget darabszámon(!), és nem dobozszámon kötelező feltüntetni. Nem szükséges latin nyelven.
A Visszavétel és Visszáru során is ugyanez az eljárás, egy különbséggel: ezekben az esetekben, ahogy a Megrendelőkönyv is meghatározza, a megrendelőlapon fel kell tüntetni, hogy milyen okból történik a visszaküldés.
Gyógyszertári nyilvántartás
Minden beszerzett és kiadott fokozottan ellenőrzött gyógyszerről, alapanyagról kötelező nyilvántartó kartont vezetni.

Selejtezés
Általánosságban elmondható, hogy egy gyógyszertárban ezekből a gyógyszerekből, kevés kivétellel, nem tartanak jelentős készleteket. A selejtezés leginkább az alapanyagokat érinti. Ebben az esetben úgynevezett Selejtezési jegyzőkönyvet állít ki a patika, és ezt fűzi hozzá az Megrendelőkönyvhöz, amikor a selejtezett alapanyagot visszaküldte a nagykereskedőhöz. Ezt a visszaküldésig a leselejtezett hatóanyag mellett érdemes tartani.

Remélem, cikkemmel hasznos információkat tudtam adni a kábító- és fájdalomcsillapító gyógyszerek, mindennapi, általában előforduló gyógyszertári kezeléséhez.


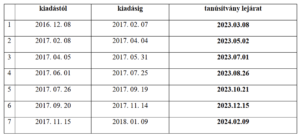











 2022. november 1-től az orvosi szoftverekben gyógyászati segédeszközt elektronikus formában kizárólag a 27-es modulban, az eGYSE-ként lehet felírni. 2023. január 28. után kizárólag az e modulban felírt elektronikus receptek számolhatók el a NEAK felé. Ugyanakkor, miután a gyógyászati segédeszköz vények kiválthatósága 90 nap, így a 2022. november 1. előtt 22-es eRecept modulban felírt gyógyászati segédeszköz elektronikus vényei 2023. január 28-ig kiadhatóak.
2022. november 1-től az orvosi szoftverekben gyógyászati segédeszközt elektronikus formában kizárólag a 27-es modulban, az eGYSE-ként lehet felírni. 2023. január 28. után kizárólag az e modulban felírt elektronikus receptek számolhatók el a NEAK felé. Ugyanakkor, miután a gyógyászati segédeszköz vények kiválthatósága 90 nap, így a 2022. november 1. előtt 22-es eRecept modulban felírt gyógyászati segédeszköz elektronikus vényei 2023. január 28-ig kiadhatóak.